| |
| Med Sci (Paris). 2007 June; 23(6-7): 572–575. Published online 2007 June 15. doi: 10.1051/medsci/20072367572.Punaises aquatiques et transmission de Mycobacterium ulcerans
Laurent Marsollier,1,2* Jacques Aubry,3 Geneviève Milon,4 and Priscille Brodin2* 1Groupe d’Étude des Interactions Hôtes UPRES-EA 3142, Université d’Angers, Angers, France 2Équipe Avenir, Institut National de la Santé et de la Recherche Médicale (Inserm), Institut Pasteur Korea, Séoul, Corée du Sud 3Institut National de la Santé et de la Recherche Médicale (Inserm), U601, Université de Nantes, France 4Unité d’Immunophysiologie et Parasitisme Intracellulaire, Institut Pasteur, 25, rue du Docteur-Roux, 75015 Paris, France MeSH keywords: Animaux, Géographie, Humains, Insectes, Infections à mycobactéries non tuberculeuses, Mycobacterium ulcerans, Eau |
L’ulcère de Buruli : une infection à Mycobacterium ulcerans
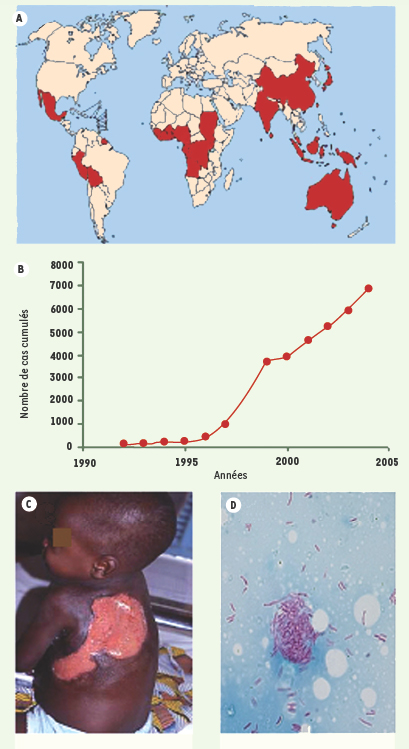
L’ulcère de Buruli est causé par une mycobactérie environnementale : Mycobacterium ulcerans. Cette maladie infectieuse sévit surtout dans les régions tropicales humides en particulier dans l’Afrique de l’Ouest où elle est endémique (Figure 1). C’est la troisième mycobactériose humaine après la lèpre et la tuberculose, mais, dans certaines zones rurales de plusieurs pays (Bénin, Côte d’Ivoire, Ghana), le taux de prévalence de l’ulcère de Buruli est supérieur à celui de la lèpre et de la tuberculose. C’est ce qui a amené l’OMS à agir, et en 1998, à déclarer l’ulcère de Buruli « maladie émergente ».  | Figure 1.
Généralités sur l’ulcère de Buruli. A. Répartition géographique des cas d’ulcère de Buruli (source OMS). L’ulcère de Buruli est une maladie qui sévit principalement en zone tropicale humide et tout particulièrement autour du golfe de Guinée où elle s’étend de façon endémique depuis une vingtaine d’années. B. L’ulcère de Buruli, maladie émergente. L’évolution du nombre de cas cumulés devient préoccupante dans plusieurs pays comme le Bénin entre 1990 et 2005. C. Forme avancée de l’ulcère de Buruli. Ulcération étendue dans le dos d’un enfant. La périphérie de la lésion est hyperpigmentée témoignant d’une nécrose tissulaire en progession. D.
Mycobacterium ulcerans. L’agent responsable de l’ulcère de Buruli est M. ulcerans, bacille de la même famille que ceux de la tuberculose et de la lèpre et qui sont mis en évidence par la coloration de Ziehl-Neelsen à partir de broyat des tissus infectés. Il forme des aggrégats rappelant les globus formés par M. leprae. |
 | Figure 2.
Écologie et transmission de M. ulcerans. A. L’eau, réservoir du germe. L’environnement aquatique serait le réservoir du germe et l’homme s’y contaminerait lors de ses activités (pêche, baignades, lavage du linge). B. Naucoris cimicoïdes est une punaise d’eau retrouvée en France qui peut être colonisée expérimentalement par M. ulcerans. Les stylets de son rostre se déploient au moment de la piqûre et pénètrent dans la chair comme une aiguille pour injecter ensuite le suc digestif provenant des glandes salivaires. Barres (encart supérieur) 0,3 cm ; (encart inférieur) 2 mm. C. Les punaises aquatiques sont des insectes carnivores exclusifs. Belostoma cordofana (punaise géante) en captivité se nourrissant d’un poisson. D. Un mode de transmission de Mycobacterium ulcerans. Des mollusques aquatiques ou d’autres animaux phytophages sont des sources transitoires de M. ulcerans puisqu’ils se nourrissent de plantes servant de support aux biofilms formés par le bacille. Ces proies sont dévorées par les punaises aquatiques. Les bacilles s’établissent au niveau des glandes salivaires des insectes et s’y multiplient activement. Ils peuvent être transmis à l’homme lors de piqûres accidentelles. Crédits photographiques : E. Deniaux (A et C) ; J.P. Gislard (C) ; schéma réalisé par C. Moreau (D). |
La maladie, qui touche principalement les enfants, évolue d’abord sous forme d’un nodule, ou d’un placard, accompagné souvent d’un œdème. Puis se développe une ulcération cutanée plus ou moins étendue pouvant atteindre l’os. La destruction tissulaire est due à la production d’une toxine, la mycolactone (d’une famille de macrolides toxiques) qui est le facteur principal de virulence de M. ulcerans [
1]. La phase ulcérative aboutit souvent à des invalidités ou des handicaps moteurs avec des conséquences socio-économiques désastreuses. Encore très récemment, le traitement était limité à des soins chirurgicaux par une excision large des parties atteintes jusqu’à la peau saine, nécessitant une greffe cutanée de parage. Le coût élevé de ce traitement limitait l’accès aux soins pour les malades. La démonstration, chez des souris infectées par M. ulcerans, de l’efficacité de l’association de deux antibiotiques, la rifampicine et l’amikacine, a contribué à la réalisation de deux études thérapeutiques pilotes qui ont confirmé l’intérêt de cette antibiothérapie puisque la moitié des patients a été guérie sans avoir recours à la chirurgie [
2]. À l’heure actuelle, il n’existe pas de vaccin spécifique dirigé contre M. ulcerans et l’efficacité de la vaccination BCG est, pour les formes cutanées, fort controversée [
3,
4]. |
M. ulcerans et système immunitaire Dans la mesure où M. ulcerans a un tropisme principalement cutané, il importe d’étudier les interactions bacille-système immunitaire dans le contexte peau et ganglion. Au niveau de la peau, jusqu’à très récemment il avait été estimé que le développement de M. ulcerans se déroulait au niveau de la matrice extracellulaire. Or, ces bactéries ont été détectées au sein de macrophages où elles s'y développent [
5]. L'un des scénarios possible serait le suivant : au moins pendant les phases précoces dans le derme/hypoderme les bactéries seraient intracellulaires. Pendant la phase intracellulaire précoce avant que ne soit présente à des concentrations toxiques la mycolactone, la synthèse du facteur nécrosant des tumeurs TNF est inhibée mais celle de MIP-2 est induite, cette dernière chimiokine contribuant à l'initiation et au maintien des processus inflammatoires [
6]. Ensuite, une partie de la population bactérienne devient extracellulaire dans des zones tissulaires nécrotiques et l'autre partie de la population est intracellulaire à la périphérie de la zone de nécrose. |
Écologie et transmission de M. ulcerans
Malgré les progrès diagnostiques et thérapeutiques de ces dernières années, plusieurs questions fondamentales subsistent touchant à l’écologie et au mode de transmission de M. ulcerans à l’homme et cette méconnaissance retarde la mise en place de mesures préventives voire protectrices. S’il n’y a pas de transmission inter-humaine du bacille, l’homme se contaminerait au contact de l’environnement aquatique. L’incidence croissante de la maladie et l’apparition de nouveaux foyers d’infection suggèrent que les bouleversements écologiques (déforestation, aquaculture, création de lacs artificiels, irrigation) ont favorisé le développement du, ou d’un, vecteur. Dans ce contexte, et à l’aide d’un modèle expérimental d’infection à M. ulcerans nous avons rapporté plusieurs caractéristiques originales de M. ulcerans. Nous nous étions tout d’abord interrogés sur le rôle possible des punaises aquatiques dans la transmission de M. ulcerans. Ces insectes qui appartiennent à l’ordre des hémiptères aquatiques vivent habituellement dans les marécages, les étangs ou les petits cours d’eau à faible débit. Ce sont des carnivores exclusifs qui se dissimulent parfaitement dans la végétation aquatique où ils capturent aisément leurs proies (poissons, batraciens, mollusques, larves d’insectes…). Aussitôt après l’avoir saisie par ses pattes antérieures, dites ravisseuses, l’insecte enfonce les stylets de son rostre dans les tissus de la proie, et, les stylets étant reliés par des canaux aux glandes salivaires, sécrète un puissant suc digestif aux propriétés paralysantes et protéolytiques. Les tissus de la proie ainsi prédigérés sont alors aspirés. Par ailleurs, les punaises n’hésitent pas à piquer l’homme lorsque celui-ci est à proximité ou les saisit accidentellement. Compte tenu de leur présence ubiquitaire et de la similitude de leurs propriétés physiologiques dans les différentes régions du monde, des Naucoris adultes, capturées dans l’ouest de la France et maintenues en captivité dans des aquariums ont été utilisées pour l’étude. Plusieurs semaines après qu’elles aient absorbé un repas contenant M. ulcerans, ces punaises ont été mises en présence de la queue de souris, ce qui a entraîné des piqûres, et plusieurs mois après, le développement de lésions induites par M. ulcerans [
7]. Une étude histologique a montré une localisation prépondérante sinon exclusive du bacille dans les glandes salivaires des punaises, et ce, paradoxalement, sans aucun dommage du parenchyme tissulaire malgré la capacité du bacille à produire une toxine cytotoxique [
8,
9]. Par ailleurs, nous avons rapporté que des plantes aquatiques servaient de support à la formation de biofilms [
10,
11] et pouvaient être à l’origine de la contamination transitoire de proies phytophages (mollusques) des punaises. Un travail de terrain réalisé dans des zones endémiques au Bénin a permis de confirmer la validité des données sur l’écologie et la transmission de M. ulcerans des végétaux aquatiques à l’homme via des punaises d’eau [8]. Cependant, nous ne pouvons pas exclure d’autres modes de contamination de l’homme. L’aptitude au vol de ces insectes ne doit pas être négligée car elle peut faciliter la création de nouveaux foyers. |
Rôle protecteur de la salive d’insecte contre le développement de lésions à M. ulcerans
Frappés par le fait que les pêcheurs africains les plus exposés aux piqûres d’insectes aquatiques étaient les moins atteints par l’ulcère de Buruli, nous avons émis l’hypothèse selon laquelle des piqûres régulières d’insectes sains pouvaient conférer une protection contre la formation de lésions à M. ulcerans. Dans le modèle murin que nous avons développé, des souris exposées à des piqûres de naucoris saines non infectées développaient rarement des lésions lors d’une infection ultérieure par M. ulcerans. La protection conférée aux souris par les piqûres d’insectes non infectés est associée à la production d’anticorps réagissant contre les protéines salivaires de naucoris, protéines qui entourent M. ulcerans pendant son séjour dans les glandes salivaires, et sont transmises avec le parasite lors de la piqûre. Ainsi, le parasite serait une cible « innocente » de cette réaction immune qui n’est pas dirigée directement contre lui [9]. Le même mécanisme protecteur surviendrait chez l’homme, puisqu’une analyse sérologique mesurant les immunoglobulines G reconnaissant des constituants du suc salivaire des punaises, réalisée en zone endémique, a montré chez les patients présentant des lésions à M. ulcerans un taux d’IgG inférieur à celui de sujets exposés aux piqûres des insectes mais sans lésion [6]. Ces observations rappellent l’immunité protectrice conférée par une exposition préalable aux protéines salivaires des tiques et des phlébotomes vecteurs des micro-organismes responsables de la leishmaniose ou de la maladie de Lyme. Mais, pour ces deux cas, les arthropodes incriminés sont hématophages contrairement aux punaises aquatiques qui sont des carnivores. Les conséquences de ces observations sont importantes non seulement parce qu’elles identifient une signature immunitaire utile aux études épidémiologiques et à un dépistage précoce de l’ulcère de Buruli, mais aussi parce qu’elles constituent une première étape vers une meilleure compréhension de l’immunité contre cette maladie, une meilleure caractérisation des molécules salivaires liant M. ulcerans pouvant éventuellement conduire à envisager une approche vaccinale. |
Ces travaux ont reçus le soutien de la Fondation Raoul Follereau, de l’université et CHU d’Angers, l’Institut National de la Santé et de la Recherche Médicale (Inserm), de l’Institut Pasteur et de ses réseaux (PTR 212).
|
1. George KM, Chatterjee D, Gunawardana G, et al. Mycolactone: a polyketide toxin from Mycobacterium ulcerans required for virulence. Science 1999; 283 : 854–7. 2. Etuaful S, Carbonnelle B, Grosset J, et al. Efficacy of the combination rifampin-streptomycin in preventing growth of Mycobacterium ulcerans in early lesions of Buruli ulcer in humans. Antimicrob Agents Chemother 2005; 49 : 3182–6. 3. Aiga H, Amano T, Cairncross S, et al. Assessing water-related risk factors for Buruli ulcer: a case-control study in Ghana. Am J Trop Med Hyg 2004; 71 : 387–92. 4. Portaels F, Aguiar J, Debacker M, et al.
Mycobacterium bovis BCG vaccination as prophylaxis against Mycobacterium ulcerans osteomyelitis in Buruli ulcer disease. Infect Immun 2004; 72 : 62–5. 5. Torrado E, Fraga AG, Castro AG, et al. Evidence for an intramacrophage growth phase of Mycobacterium ulcerans. Infect Immun 2007; 75 : 977–87. 6. Torrado E, Adusumilli S, Fraga AG, et al. Mycolactone-mediated inhibition of TNF production by macrophages infected with Mycobacterium ulcerans has implications for the control of infection. Infect Immun 2007; 21 mai online. 7. Marsollier L, R. Robert, Aubry, J, et al.Aquatic insects as a vector for Mycobacterium ulcerans. Appl Environ Microbiol 2002; 68 : 4623–8. 8. Marsollier L, Aubry J, Coutanceau E, et al. Colonization of the salivary glands of Naucoris cimicoides by Mycobacterium ulcerans requires host plasmatocytes and a macrolide toxin, mycolactone. Cell Microbiol 2005; 7 : 935–43. 9. Marsollier L, Andre J P, Frigui W, et al. Early trafficking events of Mycobacterium ulcerans within Naucoris cimicoides. Cell Microbiol 2007; 9 : 347–55. 10. Marsollier L, Stinear T, Aubry J, et al. Aquatic plants stimulate the growth of and biofilm formation by Mycobacterium ulcerans in axenic culture and harbor these bacteria in the environment. Appl Environ Microbiol 2004; 70 : 1097–103. 11. Marsollier L, Brodin P, Jackson M, et al. Impact of Mycobacterium ulcerans biofilm on transmissibility to ecological niches and Buruli ulcer pathogenesis. PLoS Pathog 2007; 3 : e62. 12. Marsollier L, Severin T, Aubry J, et al. Aquatic snails, passive hosts of Mycobacterium ulcerans. Appl Environ Microbiol 2004; 70 : 6296–8. 13. Marsollier L, Deniaux E, Brodin P, et al. Protection against Mycobacterium ulcerans lesion development by exposure to aquatic insect saliva. PloS Med 2007; 4 : 288–95. |